

Química es el nombre de la ciencia que suele ser mencionada como la evolución de la alquimia. Los ![]() químicos se encargan de estudiar la composición, la estructura, las propiedades y los cambios de una materia.
químicos se encargan de estudiar la composición, la estructura, las propiedades y los cambios de una materia.
Como se puede suponer, se trata de un campo de estudio muy amplio. Por eso existen diferentes disciplinas y especialidades dentro de la química, de acuerdo al objeto de estudio específico, las características de la materia que se estudia, etc.
De esta manera, podemos referirnos a la química orgánica (que analiza sustancias cuyos compuestos cuentan con carbono), la química inorgánica (centrada en los compuestos y las sustancias simples que no tienen carbono) y la química analítica (la disciplina que apela a instrumentos y herramientas de laboratorio para realizar sus análisis), entre otras.
Si nos referimos a la química general, estaremos haciendo mención a la química en su sentido más amplio.
Nombre del sitio: Definición .DE Año: 2008-2017
http://definicion.de/quimica-general/
Química es la ciencia que estudia la estructura, propiedades y transformaciones de la materia (y las leyes que rigen estas transformaciones) a partir de su composición atómica".
En conclusión Química es la ciencia que estudia la composición de la materia y los cambios que en ella ocurren.
El estudio de las sustancias, sus propiedades, la estructura de la materia, la neutralización de un ácido, la reacción de un metal con el oxígeno, la combustión, el reconocimiento de diversas sales y las leyes a que responden todas estas reacciones, es considerado por la Química.
Nombre del sitio: QUÍMICA GENERAL Año: 2008
http://utnquimicageneralpp1c.blogspot.mx/2008/10/conceptos-basicos-de-qumica.html
Las características de los materiales
Vivimos en un ambiente que nos rodea de elementos que poseen naturalezas diferentes. Todos estos elementos tienen masa y ocupan un espacio, es decir, tienen materia. La materia se presenta con diferentes características y, a cada una de estas variaciones que presenta, se le denomina material.
Los materiales químicos se presentan en tres estados físicos fundamentales: sólidos, líquidos y gaseosos. Un material químico es sólido cuando tiene una forma y un volumen constante. Por otro lado, se considera que un material químico es líquido cuando su forma se ve definida por el recipiente o envase que lo contiene, presentando un volumen constante. Mientras tanto, los materiales químicos gaseosos no tienen forma ni volumen propio, la forma de estos materiales químicos depende del recipiente que los contiene y su volumen de la presión que reciben.
Nombre del sitio: Ciencias Año: 2011
http://ciencias-esbac.blogspot.mx/2011/04/caracteristicas-de-los-materiales.html
La palabra material tiene un significado muy amplio, pues se utiliza para hacer referencia a aquello con lo que están hechos los objetos. Las cosas que nos rodean están hechas de uno o más materiales. Los materiales pueden ser naturales o artificiales. Los materiales naturales se obtienen de la naturaleza y pueden tener distinto origen:
Origen animal: como la lana, la seda o el cuero. Origen vegetal: como el algodón, la madera o el lino. Origen mineral: como el mármol, la sal y los metales.
Además los materiales naturales se clasifican en:
Naturales sin elaboración: se utilizan prácticamente tal como son extraídos de la naturaleza. Por ejemplo: la sal, la lana y la madera.
Naturales con elaboración: se obtienen al procesar algunos materiales naturales. Por ejemplo: el queso y el yogur se obtienen a partir del procesamiento de la leche. Los materiales naturales que se procesan para obtener otros se denominan materias primas. En el ejemplo del queso y el yogur, la leche es la materia prima.
Los materiales artificiales: son fabricados por las personas en laboratorios por medio de técnicas muy complejas. Las materias primas a partir de las cuales se obtienen estos materiales son transformadas profundamente por los procesos que se les aplican (a diferencia de las utilizadas en los materiales naturales con elaboración). Por ejemplo del petróleo se obtienen los plásticos y la nafta.
Nombre del sitio: SCRIBD Año: 2017
https://es.scribd.com/doc/54247172/Caracteristicas-de-los-materiales
Características del conocimiento científico: el caso de la Química
El conocimiento científico es un saber crítico (fundamentado), metódico, verificable, sistemático, unificado, ordenado, universal, objetivo, comunicable (por medio del lenguaje científico), racional, provisorio y que explica y predice hechos por medio de leyes.
El conocimiento científico es crítico porque trata de distinguir lo verdadero de lo falso. Se distingue por justificar sus conocimientos, por dar pruebas de sus verdades, por eso es fundamentado, porque demuestra que es cierto.
Se fundamenta a través de los métodos de investigación y prueba, el investigador sigue procedimientos, desarrolla su tarea basándose en un plan previo. La investigación científica noes errática sino planeada.
- Su verificación es posible mediante la aprobación del examen de la experiencia. Las técnicas dela verificación evolucionan en el transcurso del tiempo.
- Es sistemático porque es una unidad ordenada, los nuevos conocimientos se integran al sistema, relacionándose con los que ya existían. Es ordenado porque no es un agregado de informaciones aisladas, sino un sistema de ideas conectadas entre sí.
Es un saber unificado porque no busca un conocimiento de lo singular y concreto, sino el conocimiento de lo general y abstracto, o sea de lo que las cosas tienen de idéntico y de permanente.
Es universal porque es válido para todas las personas sin reconocer fronteras ni determinaciones de ningún tipo, no varía con las diferentes culturas.
Es objetivo porque es válido para todos los individuos y no solamente para uno determinado. Es de valor general y no de valor singular o individual. Pretende conocer la realidad tal como es, la garantía de esta objetividad son sus técnicas y sus métodos de investigación y prueba.
Es comunicable mediante el lenguaje científico, que es preciso e unívoco, comprensible para cualquier sujeto capacitado, quien podrá obtener los elementos necesarios para comprobar la validez de las teorías en sus aspectos lógicos y verificables.
Es racional porque la ciencia conoce las cosas mediante el uso de la inteligencia, de la razón.
- El conocimiento científico es provisorio porque la tarea de la ciencia no se detiene, prosigue sus investigaciones con el fin de comprender mejor la realidad. La búsqueda de la verdad es una tarea abierta.
- La ciencia explica la realidad mediante leyes, éstas son las relaciones constantes y necesarias entre los hechos. Son proposiciones universales que establecen en qué condiciones sucede determinado hecho, por medio de ellas se comprenden hechos particulares. También permiten adelantarse a los sucesos, predecirlos. Las explicaciones de los hechos son racionales, obtenidas por medio de la observación y la experimentación. Una definición más concreta es: "La ciencia busca explicar la realidad mediante leyes, las cuales posibilitan además predicciones y aplicaciones prácticas (la tecnología). El conocimiento científico es un conocimiento objetivo que se estructura en sistemas verificables, obtenidos metódicamente y comunicados en un lenguaje construido con reglas precisas y explícitas donde se evita la ambigüedad y los sin sentidos de las expresiones."
Nombre del sitio: TARINGA!
Año: 2011
Podemos definir el método científico como el proceso que sigue la comunidad científica para dar respuesta a sus interrogantes, la secuencia de procedimientos que usa para confirmar como regla o conocimiento lo que en origen es una mera hipótesis. El método científico está basado en los principios de reproducibilidad y falsabilidad y consta fundamentalmente de cinco pasos:
Observación
Análisis sensorial sobre algo -una cosa, un hecho, un fenómeno,…- que despierta curiosidad. Conviene que la observación sea detenida, concisa y numerosa, no en vano es el punto de partida del método y de ella depende en buena medida el éxito del proceso.
Hipótesis
Es la explicación que se le da al hecho o fenómeno observado con anterioridad. Puede haber varias hipótesis para una misma cosa o acontecimiento y éstas no han de ser tomadas nunca como verdaderas, sino que serán sometidas a experimentos posteriores para confirmar su veracidad.
Experimentación
Esta fase del método científico consiste en probar -experimentar- para verificar la validez de las hipótesis planteadas o descartarlas, parcialmente o en su totalidad.
Teoría
Se hacen teorías de aquellas hipótesis con más probabilidad de confirmarse como ciertas.
Ley
Una hipótesis se convierte en ley cuando queda demostrada mediante la experimentación.
Para una mayor aclaración, te diremos que los principios de reproducibilidad y falsabilidad del método científico, mencionados en el primer párrafo, consisten en la capacidad de repetir un determinado experimento en cualquier lugar y por cualquier persona, así como la posibilidad de que cualquier proposición científica sea refutada o falsada.
Nombre del sitio: saberia Año: 2010 - 2017
http://www.saberia.com/cuales-son-los-pasos-del-metodo-cientifico/
Propiedades de los materiales
La materia es todo aquello lo cual ocupa una cierta cantidad de energía reunida en una parte del universo observable. Esto lo hace que tenga localización espacial, directamente afectada por el paso del tiempo.
Comúnmente se divide a las propiedades de la materia según propiedades generales, de todas las materias, y propiedades específicas, que son las características particulares que presenta un caso material.
Las propiedades generales de la materia
La extensión: permite ocupar un espacio determinado.
La masa: es la cantidad de materia que contiene un cuerpo.
La inercia: impide el desplazamiento sin la influencia de una fuerza, impenetrabilidad que hace que otra materia no pueda ocupar el mismo espacio.
La porosidad: implica los intersticios entre las partículas que la conforman.
La divisibilidad: es la capacidad de subdivisión en partes del todo de la materia.
La elasticidad: permite que la materia vuelva a su forma original cuando la fuerza cesa… Las propiedades específicas
La densidad: es la relación entre la masa y el volumen.
El volumen: es el punto de ebullición que se refiere a la temperatura en que, exclusivamente los líquidos, hierven.
El punto de fusión: depende de la propiedad específica de la materia sólida, por el cual pasa de la solidez a un estado líquido.
El grado de conductibilidad de energía eléctrica hay cuerpos que conducen la energía eléctrica de mayor manera que otras, también hay materias que directamente son inconducentes y aislantes de energía eléctrica, esto depende de las características particulares del cuerpo material.
El grado de conductibilidad térmica: la conducción térmica es la transferencia de energía que se expresa en el aumento o la disminución de la temperatura de la materia, como en el caso anterior es la propiedad material la que condiciona o facilita la influencia térmica.
Por otro lado las propiedades pueden ser clasificadas en extensivas o intensivas:
Las propiedades extensivas: son aquellas que el valor medido reside en las propiedades de la masa. Por ejemplo: el peso, el área, volumen, la presión de gas, la disminución o el aumento de calor, etc.
Las propiedades intensivas: en cambio son valores medidos que no dependen de la masa, por ejemplo el color, sabor, reactividad, la electronegatividad, etc.
Nombre del sitio: concepto. De Año: consulta 2017
Fuente: http://concepto.de/cuales-son-las-propiedades-de-la-materia/#ixzz4hvZsR6VM
Cambios de estado de la materia
Sólido a líquido = fusión Sólido a gas = sublimación
Gas a sólido = deposición o sublimación inversa Gas a líquido = condensación
Líquido a gas = evaporación Líquido a sólido = solidificación
Nombre del sitio: facultad de química UNAM Año: consulta 2017
http://depa.fquim.unam.mx/amyd/archivero/Introduccion_84.pdf
Cambios físicos y químicos
La ley de la conservación de la materia propuesta por Lavoisier establece que “la materia no se crea ni se destruye sólo se transforma”. Esas transformaciones son los cambios físicos y químicos.
CAMBIOS FÍSICOS
Corresponden a los cambios de la materia en los cuales la naturaleza de la sustancia permanece intacta, es decir, su estructura química se mantiene inalterable. Se considera que una sustancia ha sufrido un cambio físico, si tras el cambio, la materia sigue siendo la misma. Por ejemplo tras un cambio de estado del agua, esta se congela convirtiéndose en hielo o se evapora transformándose en vapor de agua, todas estas formas de agua están constituidas por la misma materia.
Nombre del sitio: Escolares.net Año: 2014
http://www.escolares.net/quimica/cambios-fisicos-y-quimicos-de-la-materia/
Ejemplos de cambios físicos:
Arrugar una hoja de papel; es transitorio, ya que no hay cambio de sustancia.
Romper un vidrio (Cambia su forma, pero su composición es la misma)
Hacer figuras con plastilina. No cambia la sustancia de lo que está formado, pero se le pueden dar diferentes formas y cambios a su estructura.
Cortar una hoja de papel; ambas partes cambiaron de tamaño pero siguen teniendo las mismas propiedades, no ha sufrido un cambio drástico, sigue siendo papel.
Nombre del sitio: BRAINLY Año: 2013
https://brainly.lat/tarea/180673
CAMBIOS QUÍMICOS
Los cambios químicos corresponden a una transformación de la materia donde se forman una o más sustancias (productos) a partir de la interacción de dos o más sustancias (reactantes o reactivos). Los productos tienen una estructura química diferente a los reactantes y se caracterizan por tener nuevas propiedades físicas y químicas.
Los cambios químicos son producto de las reacciones químicas, por lo tanto, es posible identificar a simple vista si existe un cambio en el color de la materia, se produce gas en forma de burbujas o efervescencia, ocurre un incendio o explosión, cambio de olor, se emite luz o calor.
Nombre del sitio: Escolares.net Año: 2014
http://www.escolares.net/quimica/cambios-fisicos-y-quimicos-de-la-materia/
Ejemplos de cambios químicos:
La digestión de los alimentos
Encender un cerillo (es un ejemplo de combustión)
Explosión de cualquier objeto (aquí es porque las llamas pueden modificar tanto el objeto hasta derretirlo o hacerlo cenizas, suponiendo que el calor fuese demasiado intenso)
La respiración (ingresa oxígeno a nuestros pulmones y se libera Dióxido de Carbono)
Nombre del sitio: BRAINLY Año: 2013
https://brainly.lat/tarea/180673
Propiedades físicas y caracterización de las substancias
A simple vista podemos distinguir entre muchos tipos de sustancias: la madera, el plástico, el oro o la plata, y muchas más. Existen, por lo tanto, características que nos permiten diferenciar los distintos tipos de materia y que reciben el nombre de propiedades características, ya que nos ayudan a caracterizar o identificar las distintas sustancias. Al contrario que propiedades generales, existen innumerables propiedades características por lo que sólo podremos considerar unas pocas, aunque nombremos muchas: color, sabor, dureza, densidad, brillo, conductividad térmica y eléctrica, punto de fusión, punto de ebullición, solubilidad, etc.
Las propiedades características como ya hemos establecido, tienen en química particular importancia pues ellas permiten reconocer una sustancia y diferenciarlas de las demás
Estas propiedades se les llaman a menudo constantes físicas, siendo su utilidad en el trabajo del químico notable, ya que sus valores son altamente confiables no solo para identificar una sustancia sino también para determinar su grado de pureza.
Para identificar una sustancia no nos bastará con conocer una de sus propiedades características, sino que habremos de identificar varias de ellas, las más importantes, y las más fáciles de determinar son: la densidad, los puntos de fusión y ebullición, relacionados con la temperatura, y la solubilidad, que también tiene que ver, de otra forma, con la temperatura.
Las propiedades características se determinan a través de análisis, estos análisis son análisis cualitativo y análisis cuantitativo.
En los análisis cuantitativos se encuentran las propiedades características medibles; y en el análisis cualitativo se encuentra las propiedades características no medibles.
Las propiedades características medibles son:
Densidad: masa de un cuerpo por unidad de volumen
Punto de fusión: temperatura a la que el estado sólido y el estado líquido de una sustancia se encuentran en equilibrio.
Punto de ebullición: temperatura a la que la presión de vapor de un líquido se iguala a la presión atmosférica existente sobre dicho líquido.
Solubilidad: La solubilidad es una medida de la capacidad de una determinada sustancia para disolverse en otra. Puede expresarse en moles por litro, en gramos por litro, o en porcentaje de soluto; en algunas condiciones se puede sobrepasarla, denominándose a estas soluciones sobresaturadas. El método preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra. La sustancia que se disuelve se denomina soluto y la sustancia donde se disuelve el soluto se llama disolvente.
Las propiedades características no medibles son:
Olor: es una propiedad intrínseca de la materia y se define como la sensación resultante de la recepción de un estímulo por el Sistema Sensorial Olfativo.
Sabor: es la impresión que nos causa un alimento u otra sustancia, y ésta determina principalmente por sensaciones alucinógenas combinadas, detectada por el gusto.
Textura: es la propiedad que tienen las superficies externas de los objetos, así como las sensaciones que causan, que son captadas por el sentido del tacto.
Brillo: es el resultante de la reflexión y la refracción de la luz en la superficie de un mineral.
Nombre del sitio: monografías.com Año: 2008
http://www.monografias.com/trabajos71/propiedades-caracteristicas-quimica/propiedades-caracteristicas- quimica.shtml#ixzz4i1joiq00
La conservación de la masa en los cambios físicos y químicos
![]()
En los cambios físicos, las sustancias mantienen su naturaleza y sus propiedades esenciales, es decir, siguen siendo las mismas sustancias.
En los cambios químicos, las sustancias iniciales se transforman en otras distintas, que tienen propiedades diferentes.
Como ya sabes, en toda reacción química se forman unos productos a partir de unos reactivos. ¿Pero qué ocurre con las masas de estas sustancias?
Preparamos una disolución de nitrato de plomo en un vaso y otra de yoduro de potasio en otro. Las colocamos en una balanza y comprobamos que entre las dos pesan: 222,1 g. Después las mezclamos, y vemos que aparece una sustancia nueva (precipitado amarillo): el yoduro de plomo. Nuevamente las colocamos en la balanza y comprobamos que pesan 222,1 g. |
Reacción química entre el nitrato de plomo y el yoduro de potasio. |
La masa no ha variado.
| |
Como una reacción química es una recombinación de los enlaces entre átomos, la masa total antes y después de que se produzca es la misma. Esta idea constituye la ley de conservación de la masa.

El químico Lavoisier enunció por primera vez esta ley, llamada también ley de Lavoisier. Fue el comienzo de la Química moderna.
Ley de Lavoisier: En toda reacción química la suma de las masas de los reactivos es igual a la masa de los productos.
![]()
Nombre del sitio: librosvivos.net Año de consulta: 2017
http://www.librosvivos.net/smtc/pagporformulario.asp?idIdioma=ES&TemaClave=1072&pagina=8&est=3
La diversidad de las sustancias y los métodos de separación
Una sustancia pura es aquella que tiene unas propiedades específicas que la caracterizan y que sirven para diferenciarla de otras sustancias. Una sustancia pura no se puede separar en otras sustancias por procedimientos físicos. Las sustancias puras a su vez pueden ser elementos o compuestos.
Una mezcla es una combinación de dos o más sustancias que conservan su identidad y propiedades.
Habitualmente, las sustancias que nos encontramos en la naturaleza son mezclas. Los métodos que utilizamos para obtener las sustancias puras de una mezcla son procesos que se basan en diferenciar sus propiedades físicas (aquellas que se pueden medir u observar sin alterar la composición de la sustancia como color, olor, forma o masa). Para separar los compuestos en elementos se utilizan métodos químicos.
La explicación de los cambios en la materia se realiza a través de:
El modelo cinético molecular: nos permite explicar los cambios físicos que se producen suponiendo que las moléculas se mueven más o menos rápidamente y se alejan y acercan unas de otras. Sin embargo, los cambios físicos no producen cambios en las moléculas, ya que las sustancias siguen siendo las mismas.
La Teoría atómica de Dalton. Esta nos ofrece una explicación a los cambios químicos. Es decir, nos puede explicar por qué unas sustancias se convierten en otras.
Nombre del sitio: intef Año: consulta 2017
http://descargas.pntic.mec.es/cedec/proyectoedia/reanaturales/contenidos/deconstruyendo_la_materia/la_mat eria_y_las_mezclas.html
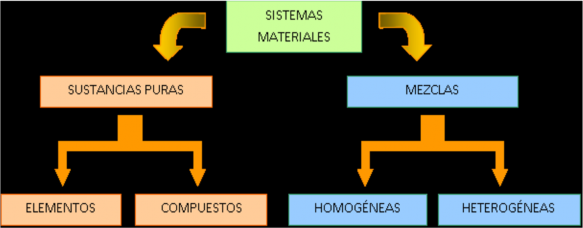
La materia se presenta en la naturaleza en forma de sustancias puras y mezclas, de modo que podemos establecer la siguiente clasificación:
Los elementos son sustancias puras simples, constituidas por un mismo tipo de átomos, como oxígeno (O2), nitrógeno (N2), helio (He). Son algo más de cien y se hallan recogidos en la tabla periódica.
Los compuestos son sustancias puras constituidas por dos o más elementos. Presentan una fórmula química característica. Por ejemplo, agua (H2O).
Las mezclas son agrupaciones de dos o más sustancias puras en proporciones variables. Si presentan un aspecto uniforme son homogéneas y también se denominan disoluciones, como la de azúcar en agua. Si su aspecto no es uniforme, la mezcla es heterogénea, como el granito. CLASIFICACIÓN DE LA MATERIA 1) Clasifica los siguientes tipos de materia: • Zumo de naranja natural • Agua de piscina • Mercurio de un termómetro • Un cable de cobre pelado • Granito • Aire puro • Agua destilada • Agua de un pantano cenagoso • Vapor de agua.
Nombre del sitio: DIVERSIDAD Y ESTRUCTUTA DE LA MATERIA
Año: consulta 2017 http://www.iesseneca.net/iesseneca/IMG/pdf/ESTRUCTURA_DE_LA_MATERIA_-_1.pdf
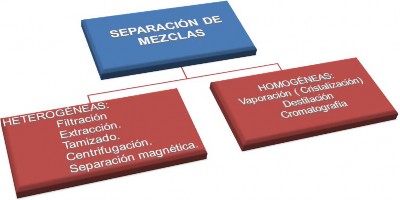
Los procedimientos físicos por los cuales se separan las mezclas se denominan métodos de separación. Éstos se pueden clasificar como se presentan a continuación:
FILTRACIÓN
Es un tipo de separación mecánica, que sirve para separar sólidos insolubles de grano fino de un líquido en el cual se encuentran mezclados. Este método consiste en verter la mezcla a través de un medio poroso (filtro) que deje pasar el líquido y retenga el sólido. Los aparatos usados son el papel filtro, embudo tallo largo, soporte para embudo y vaso de precipitado.
EXTRACCIÓN
Es un procedimiento de separación de una sustancia que puede disolverse en dos disolventes no miscibles entre sí, con distinto grado de solubilidad y que están en contacto a través de una interface. A nivel de laboratorio el proceso se desarrolla en un embudo de decantación.
TAMIZADO
Es un método de separación de mezclas sólidas formadas por componentes con diferentes tamaños de partículas. Consiste en hacer pasar la mezcla de partículas de diferentes tamaños por un tamiz o cedazo. Las partículas de menor tamaño pasan por los poros del tamiz y las grandes quedan retenidas.
CENTRIFUGACIÓN
Es un método por el cual se pueden separar sólidos de líquidos de diferente densidad mediante una fuerza centrífuga. La fuerza centrífuga es provista por una máquina llamada centrifugadora o centrífuga, la cual imprime a la mezcla un movimiento de rotación que origina una fuerza que produce la sedimentación de los sólidos o de las partículas de mayor densidad…
SEPARACIÓN MAGNÉTICA
Es un proceso que sirve para separar dos sólidos (en la que uno de los cuales debe ser ferroso o tener propiedades magnéticas). El método consiste en acercar un imán a la mezcla a fin de generar un campo magnético, que atraiga al compuesto ferroso dejando solamente al material no ferroso en el contenedor.
CRISTALIZACIÓN
Proceso por el que una sustancia adopta la forma de sólido cristalino partiendo del mismo producto de su disolución. Se lleva a cabo cuando la solución se somete a calentamiento para vaporizar el solvente, quedando el soluto sólido en el recipiente.
DESTILACIÓN
Es el procedimiento de separar, mediante vaporización y condensación de los diferentes componentes líquidos de una mezcla homogénea, aprovechando las diferentes temperaturas de ebullición de cada una de las sustancias.
CROMATOGRAFÍA
Es un método físico de separación para la caracterización de mezclas complejas, la cual tiene aplicación en todas las ramas de la ciencia. Es un conjunto de técnicas basadas en el principio de retención selectiva, cuyo objetivo es separar los distintos componentes de una mezcla, permitiendo identificar y determinar las cantidades de dichos componentes…
Nombre del sitio: Química General Año: 2016
http://quimicageneraling.blogspot.mx/p/metodos-de-separacion-de-mezclas.html
Estructura y Periodicidad de los elementos
Materia es todo lo que tiene masa y ocupa un lugar en el espacio llamada volumen. En el vacío no hay materia. Todo lo que podemos ver y tocar es materia. También son materia cosas que no podemos ver, como el aire.
Todos los cuerpos están formados por materia, cualquiera que sea su forma, tamaño o estado. Pero no todos están formados por el mismo tipo de materia, sino que están compuestos por sustancias diferentes.
La manera más adecuada de definir la materia es describiendo sus cualidades:
Presenta dimensiones, es decir, ocupa un lugar en el espacio.
Presenta inercia: que es la resistencia que opone la materia a modificar su estado de reposo.
La materia es la causa de la gravedad o gravitación, que consiste en la atracción que actúa siempre entre objetos materiales aunque estén separados por grandes distancias.
Nombre del sitio: inSlideShare Año: 2011
https://es.slideshare.net/albertojeca/materia-estructura-y-peridiocidad
Características de los protones, electrones y neutrones
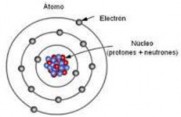
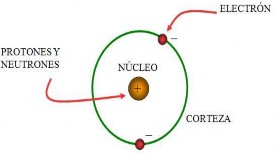
Los antiguos griegos designaron con la palabra átomo a las unidades más pequeñas que forman la materia. Literalmente significa: partícula indivisible.
Los experimentos de Thomson, a finales del siglo XIX, demostraron que la carga eléctrica reside en el átomo, que realmente no es indivisible como se había creído hasta entonces y que está formado por dos tipos de partículas: unas son mayores, los protones, y están cargadas positivamente, y otras son mucho más pequeñas y están cargadas negativamente, los electrones.
Es interesante señalar que, a pesar de poseer masas muy diferentes, los protones y los electrones tienen la misma carga, si bien es de signo opuesto. Thomson halló que la parte positiva del átomo contiene una masa mucho mayor que la negativa, a pesar de que sus cargas son iguales y el átomo es eléctricamente neutro.
El átomo encierra mucho espacio vacío y casi toda su masa se acumula en la zona central o núcleo, que posee carga positiva por hallarse allí los protones, mientras que los electrones negativos se mueven en la corteza, describiendo órbitas circulares alrededor del núcleo. Además, los átomos son neutros porque el número de electrones es igual al de protones. En el núcleo también existen unas partículas de tamaño ligeramente superior al protón, aunque sin carga eléctrica: los neutrones.
CLASIFICACIÓN DE LOS ELEMENTOS
En el siglo XIX se habían descubierto muchos elementos y surgió la necesidad de hacer una clasificación. Tras varios intentos, el ruso Mendeleiev propuso ordenarlos por su número atómico o número de protones en 7 filas o períodos y 18 columnas o grupos. Así se construyó la TABLA PERIÓDICA.
Los elementos del mismo grupo poseen unas características similares. Así, encontramos los del primer grupo o elementos alcalinos, Li, Na, K, Rb, Cs y los del segundo grupo, o alcalinotérreos, Be, Mg, Ca, Sr, Ba. Los del grupo 17 se llaman halógenos: F, Cl, Br y I.
Los metales se disponen a la izquierda y en el centro de la tabla y los no metales a la derecha. En la zona divisoria, señala en la tabla como una “escalera”, están los semimetales.
Nombre del sitio: DIVERSIDAD Y ESTRUCTURA DE LA MATERIA
Año: consulta 2017 http://www.iesseneca.net/iesseneca/IMG/pdf/ESTRUCTURA_DE_LA_MATERIA_-_1.pdf
Número atómico y número de masa
Número atómico es el número de protones que hay en el núcleo atómico, se simboliza por la letra Z. Coincide con el número de electrones si el átomo es neutro.
Número de masa es la suma del número de protones más el número de neutrones (es el número de nucleones) se representa con la letra A.
Has de tener presente que:
Los símbolos químicos pueden estar rodeados de 4 números: a la izquierda, en la parte superior el número másico (A) (número de masa), y en la parte inferior el número atómico (Z), a la derecha, en la parte superior, la carga iónica si ha perdido o ganado electrones (Q), en la parte inferior, el número de átomos presentes en ese elemento (n).
![]()
Número de masa (A) (Q) Carga iónica Número atómico (Z) (n) Átomos presentes
Nombre del sitio: ESTRUCTURA ATÓMICA Año: consulta 2017
http://assets.mheducation.es/bcv/guide/capitulo/8448180488.pdf
Número atómico, masa atómica y masa atómica relativa
Los átomos de cada elemento tienen un número característico de protones. De hecho, este determina qué átomo estamos viendo (por ejemplo, todos los átomos con 6 protones son átomos de carbono); el número de protones de un átomo se denomina número atómico. En cambio, el número de neutrones de un elemento dado puede variar. Las formas del mismo átomo que difieren solo en el número de neutrones se llaman isótopos. En conjunto, el número de protones y de neutrones determinan el número de masa de un elemento (número de masa = protones + neutrones). Si quieres calcular cuántos neutrones tiene un átomo, solo tienes que restar el número de protones, o número atómico, del número de masa.
Una propiedad estrechamente relacionada con el número de masa de un átomo es su masa atómica. La masa atómica de un átomo individual es simplemente su masa total y generalmente se expresa en unidades de masa atómica (uma). Por definición, un átomo de carbono con seis neutrones (carbono-12) tiene una masa atómica de 12 uma. Por razones que van más allá de lo que abarca este artículo, otros tipos de átomos generalmente no tienen masas atómicas de números redondos. Sin embargo, la masa atómica de un átomo en general será muy cercana a su número de masa aunque tendrá algunas diferencias en los decimales.
Debido a que los isótopos de un elemento tienen diferentes masas atómicas, los científicos también pueden determinar la masa atómica relativa (denominada algunas veces peso atómico) de un elemento. La masa atómica relativa es un promedio de las masas atómicas de los diferentes isótopos en una muestra y la contribución de cada isótopo al promedio se determina por medio de la cantidad que representa dentro de la muestra. Las masas atómicas relativas que aparecen en la tabla periódica (como la del hidrógeno, que se muestra a continuación) se calculan en todos los isótopos naturales de cada elemento, los cuales se ponderan con base en su abundancia en la Tierra. Los objetos extraterrestres, como los asteroides o meteoritos, pueden tener abundancias de isótopos muy distintas.
Imagen que muestra la "anatomía" de una de las entradas de la tabla periódica. En la parte superior izquierda se encuentra el número atómico, o el número de protones. En medio, están las letras que simbolizan el elemento (por ejemplo, H). Abajo, se indica la masa atómica relativa, tal como se calculó en los isótopos que se encuentran de manera natural en la Tierra. Al final, se señala el nombre del elemento (por ejemplo, hidrógeno).
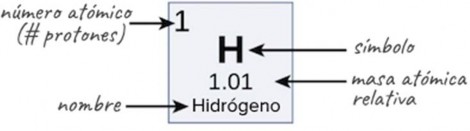
Crédito de imagen: modificada de OpenStax CNX Biology
Nombre de sitio: KHANACADEMY Año: consulta 2017
https://es.khanacademy.org/science/biology/chemistry--of-life/elements-and-atoms/a/atomic-number-atomic- mass-and-isotopes-article
Iones, moléculas y átomos
Iones son los átomos que han perdido o ganado electrones, con lo que han obtenido una carga eléctrica positiva o negativa respectivamente.
http://assets.mheducation.es/bcv/guide/capitulo/8448180488.pdf
Un átomo es la parte más pequeña de materia que puede combinarse químicamente con otro. Se trata de un núcleo compuesto por protones y neutrones, alrededor del cual orbitan los electrones.
Estas partículas no sólo tienen masa, sino también una notable propiedad llamada carga eléctrica:
El protón lleva una carga elemental positiva, denotada e+
El electrón tiene una carga de igual valor, pero negativa, denotada por e-
El neutrón es neutro.
El número de protones en un átomo caracteriza su nombre:
Un protón: Hidrógeno
2 protones: Helio
17 protones: Cloro
Un átomo tiene tantos protones como electrones. La carga total es cero, por lo que el material es globalmente neutro.
En algunos casos, con la ayuda de un aporte de energía externa, un átomo puede perder o ganar uno o más electrones. Este es el fenómeno de la ionización.
Ejemplo: Un átomo de sodio (Na) tiene 11 protones y 11 electrones. Este puede llegar a perder un electrón. A continuación, tiene 11 protones, pero ahora tiene 10 electrones. Una carga positiva +e ya no es compensada, y se obtiene que el ion sodio tiene carga positiva. El ion sodio se denota Na+ para indicar que tiene una carga
+e.
Una molécula es un conjunto de átomos que comparten electrones para lograr una mayor estabilidad. Nombre del sitio: eduMedia
Año: 2017
https://www.edumedia-sciences.com/es/media/715-atomos-iones-y-moleculas
Átomo
El átomo es la pieza más básica de materia; toda cosa física está compuesta de millones de átomos. El átomo en si consiste en tres partículas principales: electrones, protones y neutrones. Los números de estas partículas en un átomo designan lo que es, por ejemplo, carbono, oro u oxígeno. Los protones y los neutrones se encuentran juntos en el centro del átomo en una parte llamada núcleo. Alrededor de este núcleo se encuentran los electrones. En un átomo normal existe el mismo número de electrones con carga negativa y protones de carga positiva, lo que significa que los átomos tienen una carga neutral.
Molécula
Las moléculas son el siguiente paso, ya que son una colección de átomos conectados. Todo sobre la tierra, sea orgánico o inorgánico, está compuesto de moléculas, que pueden consistir en únicamente dos átomos o millones de ellos. Las combinaciones y las formas en que los átomos se conectan deciden lo que será la
molécula. Por ejemplo, cuando dos átomos de hidrógeno se combinan con un átomo de oxígeno, se crea una molécula de agua. Otras moléculas incluyen grasas, alcoholes, proteínas y fibras.
Ion
Un ion es un átomo o molécula en el que la carga neutral normal ha sido convertida en positiva o negativa. Cuando la carga no es neutral provoca que los átomos individuales sean atraídos a otros átomos que poseen la carga opuesta. La carga en un átomo se cambia cuando el electrón es añadido o removido para provocar que la relación entre electrones y protones se desequilibre. Cuando se remueven electrones, el átomo obtiene una carga positiva; cuando se suman, se vuelve negativo.
Compuesto
Las moléculas y los compuestos son esencialmente la misma cosa ya que ambos están compuestos de átomos que están unidos. La única diferencia es que una molécula puede estar compuesta de un solo tipo de elemento como oxígeno, hidrógeno o nitrógeno. Para ser un compuesto debe haber más de un tipo de átomo en la molécula, por ejemplo, el agua, que tiene hidrógeno y oxígeno, o el dióxido de carbono, que tiene carbono y oxígeno.
Nombre del sitio: Diferencia entre átomos, iones, moléculas y compuestos Año: 2014
http://www.ehowenespanol.com/diferencia-atomos-iones-moleculas-compuestos-info_458236/
Estructura de Lewis
En 1916 Gilbert Newton Lewis (1875-1949) explicó la formación del enlace covalente mediante la compartición de pares de electrones. Otros destacados trabajos de este científico fueron una teoría generalizada de los ácidos y bases o el estudio de la interacción de la luz con las substancias.
La teoría de Lewis parte de considerar que los átomos se unen mediante enlace covalente compartiendo alguno de los electrones de su capa de valencia (electrones de valencia) hasta alcanzar un número de ocho alrededor (regla del octeto) como los gases nobles, excepto en el caso del Hidrógeno que comparte su único electrón alcanzando dos alrededor (como el Helio).
Los electrones de valencia de un átomo son los de su capa más externa (hoy sabemos que se corresponden con los de número cuántico principal, n, más grande) y vienen dados por su posición en la Tabla periódica.
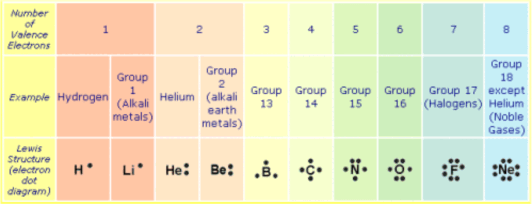
Los electrones de valencia se representan por puntos alrededor del símbolo del elemento.
La formación de un enlace covalente como el de la molécula de HF (fluoruro de hidrógeno) puede esquematizarse de la siguiente manera:
![]()
Cada par de electrones compartidos es un enlace covalente el cual puede representarse mediante un segmento.
Nombre del sitio: quimica2bac Año: 2012
https://quimica2bac.wordpress.com/2012/10/25/estructuras-de-lewis/
Los gases nobles se encuentran formados por átomos asilados porque no requiren compartir electrones entre dos o más átomos, ya que tienen en su capa de valencia ocho electrones, lo que les da su gran estabilidad e inercia.
Los otros elementos gaseosos en cambio, se encuentran siempre formando moléculas diatómicas. Veamos por que.
Cada átomo de flúor tiene siete electrones en su capa de valencia, le falta sólo uno para lograr completar los ocho, que según la Regla del Octeto, le dan estabilidad.
Si cada átomo de flúor comparte su electrón impar con otro átomo de flúor, ambos tendrán ocho electrones a su alrededor y se habrá formado un enlace covalente con esos dos electrones que se comparten entre ambos átomos

Esta idea de la formación de un enlace mediante la compartición de un par de electrones fue propuesta por Lewis, y sigue siendo un concepto fundamental en la comprensión del enlace químico.
Podemos aplicar el modelo de Lewis para explicar la formación de la molécula de Oxígeno
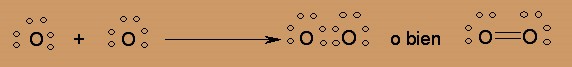
Para que cada uno de los dos átomos de oxígeno complete un octeto de electrones, es necesario que compartan entre ellos DOS pares electrónicos. A esta situación se le conoce como DOBLE ENLACE.
De manera análoga, la formación de la molécula diatómica de nitrógeno mediante el modelo de Lewis, lleva a plantear un TRIPLE ENLACE entre los átomos de N, para que ambos completen el octeto.
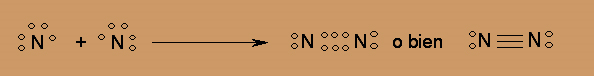
El hidrógeno elemental también está constituido por moléculas diatómicas, pero debido a que están formadas por átomos con un solo electrón, es imposible que cumpla con la regla del octeto, el hidrógeno sólo tiende a tener DOS electrones alrededor.
![]()
Otros ejemplos de sustancias gaseosas, pero formados por dos elementos son; los óxidos de carbono, los óxidos de nitrógeno y los halogenuros de hidrógeno.
A continuación se ve la representación de Lewis para estos últimos; X puede ser F, Cl, Br ó I, todos ellos tienen siete electrones en su capa de valencia:
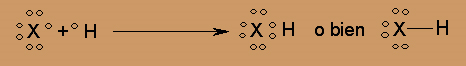
Otros ejemplos de compuestos gaseosos formados por moléculas con más de dos átomos, son: los dióxidos de carbono, nitrógeno y azufre, (CO2, NO2, SO2). El amoniaco (NH3), el metano (CH4), y el sulfuro de hidrógeno (H2S).
Método general para obtener estructuras de Lewis
· Observa el tipo y el número de átomos que tiene el compuesto, a partir de su fórmula química.
· Determina el número de electrones de valencia que tiene cada átomo, para lo cual puedes utilizar su posición en la tabla periódica. Con esta información también conoces el número total de electrones de valencia que vas a utilizar para construir la estructura de puntos.
· Dibuja una propuesta de esqueleto para el compuesto. Para ello une a los átomos presentes entre sí con líneas rectas (éstas representan pares de electrones compartidos, o sea, enlaces sencillos). Este paso puede resultar difícil, ya que no es común contar con suficiente información para esbozar el esqueleto. Sin embargo, y a menos que tengas alguna otra información, asume que en moléculas sencillas que tienen un átomo de un elemento y varios átomos de otro, el átomo único está en el centro.
· Coloca los puntos alrededor de los átomos de tal manera que cada uno tenga ocho electrones (para cumplir con la regla del octeto). Recuerda que el hidrógeno es una excepción y tan sólo tendrá dos puntos.
· Verifica que el número total de electrones de valencia esté plasmado en tu estructura. Si no es el caso, posiblemente se trate de un compuesto que no satisface la regla del octeto (ve la sección
Como un ejemplo del empleo de estas reglas, en la Tabla 5 se resume la determinación de la estructura de puntos del cloroformo, CHCl3. El compuesto cumple con la regla del octeto y al completar los octetos de carbono y cloros nos encontramos con los 26 electrones de valencia en total.
Tabla. Determinación de la estructura de Lewis del CHCl3.
Molécula | Tipo y número de átomos | Electrones de valencia de cada átomo | Número total de electrones de valencia | Estructura del esqueleto | Arreglo de los puntos |
CHCl3 | C=1 H=1 Cl=3 | C=4 H=1 Cl=7 | C=1x4=4 H=1x1=1 Cl=3x7=21 TOTAL=26 |
|
|
Nombre del sitio: Estructuras de Lewis Año: consulta 2017
http://montenegroripoll.com/Quimica2/Tema3/lewis.htm
2.8 Estructura y organización de los elementos en la tabla periódica
La tabla periódica actual es un sistema donde se clasifican los elementos conocidos hasta la fecha. Se colocan de izquierda a derecha y de arriba a abajo en orden creciente de sus números atómicos. Los elementos están ordenados en siete hileras horizontales llamadas periodos, y en 18 columnas verticales llamadas grupos o familias.
Hacia abajo y a la izquierda aumenta el radio atómico y el radio iónico. Hacia arriba y a la derecha aumenta la energía de ionización, la afinidad electrónica y la electronegatividad.
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos o familias. Hay 18 grupos en la tabla periódica estándar, de los cuales diez son grupos cortos y los ocho restantes largos, que muchos de estos grupos correspondan a conocidas familias de elementos químicos. La tabla periódica se ideó para ordenar estas familias de una forma coherente y fácil de ver, todos los elementos que pertenecen a un grupo tienen la misma valencia, entendido como el número de electrones en la última capa, y por ello, tienen propiedades similares entre sí.
La explicación moderna del ordenamiento en la tabla periódica es que los elementos de un grupo poseen configuraciones electrónicas similares y la misma valencia, o número de electrones en la última capa. Dado que las propiedades químicas dependen profundamente de las interacciones de los electrones que están ubicados en los niveles más externos, los elementos de un mismo grupo tienen propiedades químicas similares.
![]()
Por ejemplo, los elementos en el grupo 1 tienen una configuración electrónica ns1 y una valencia de 1 (un electrón externo) y todos tienden a perder ese electrón al enlazarse como iones positivos de -1. Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son excepcionalmente no reactivos y son también llamados gases inertes.
Numerados de izquierda a derecha utilizando números arábigos, según la última recomendación de la IUPAC (según la antigua propuesta de la IUPAC) de 1988 y entre paréntesis según el sistema estadounidense, los grupos de la tabla periódica son:
Grupo 1 ( I A ): los metales alcalinos
Grupo 7 ( VII B ): familia del Manganeso
Grupo 13 ( III A ): los térreos
Grupo 2 ( II A): los metales alcalinotérreos
Grupo 8 ( VIII B ): familia del Hierro
Grupo 14 ( IV A ): los carbonoideos
Grupo 3 ( III B): familia del Escandio (tierras raras y actinidos)
Grupo 9 ( VIII B ): familia del Cobalto
Grupo 15 ( V A ): los nitrogenoideos
Grupo 4 ( IV B ): familia del Titanio
Grupo 10 ( VIII B ): familia del Níquel
Grupo 16 ( VI A ): los calcógenos o anfígenos
Grupo 5 ( V B ): familia del Vanadio
Grupo 11 ( I B ): familia del Cobre
Grupo 17 ( VII A ): los halógenos
Grupo 6 ( VI B ): familia del Cromo
Grupo 12 ( II B ): familia del Zinc
Grupo 18 ( VIII A ): los gases nobles
Periodos
Las filas horizontales de la tabla periódica son llamadas periodos. El número de niveles energéticos de un átomo determina el periodo al que pertenece. Cada nivel está dividido en distintos subniveles, que conforme aumenta su número atómico se van llenando en este orden. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica y da forma a la tabla periódica. Los electrones situados en niveles más externos determinan en gran medida las propiedades químicas, por lo que estas tienden a ser similares dentro de un mismo grupo, sin embargo la masa atómica varía considerablemente incluso entre elementos adyacentes. Al contrario, dos elementos adyacentes de mismo periodo tienen una masa similar, pero propiedades químicas diferentes.
La tabla periódica consta de 7 periodos: Periodo 1, Periodo 2. Periodo 3, Periodo 4, Periodo 5, Periodo 6 y
Periodo 7
Bloques
La tabla periódica se puede también dividir en bloques de elementos según el orbital que estén ocupando los electrones más externos, de acuerdo al principio de Aufbau. Los bloques o regiones se denominan según la letra que hace referencia al orbital más externo: s, p, d y f. Podría haber más elementos que llenarían otros orbitales, pero no se han sintetizado o descubierto: en este caso se continúa con el orden alfabético para nombrarlos: Bloque s, Bloque p, Bloque d, Bloque f, Bloque g (bloque hipotético).
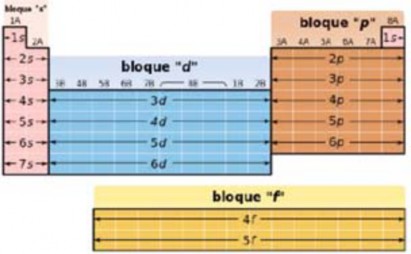
Nombre del sitio: Academia Año: 2017
http://www.academia.edu/23837365/Estructura_y_organizaci%C3%B3n_de_la_tabla_peri%C3%B3dica
Enlace químico
El término enlace químico es utilizado para referirse a la unión que existe entre dos átomos (los cuales pueden ser iguales o diferentes) con el fin de formar una molécula. Los átomos están compuestos por un núcleo atómico y a la vez están rodeados por electrones (los cuales tienen carga eléctrica negativa). En un enlace químico existe la participación entre los electrones que componen a los átomos que se están entrelazando, debido a que es a través de ellos que los enlaces se unen; en términos químicos se dice que es una transferencia de electrones entre átomos el fenómeno que ocurre en un enlace químico.
En el mundo en el que vivimos solo los gases nobles y los metales en estado de vapor están presentes naturalmente como átomos aislados, es decir, átomos solos, que no se unen para crear una molécula, por ello se puede afirmar que la mayoría de los elementos que existen son formados por enlaces químicos, los cuales se forman con el fin de alcanzar la estabilidad química. Los enlaces se forman como consecuencia del movimiento que existe entre los electrones de valencia de un átomo, que son los electrones que se encuentran en la capa más externa, es decir, los del último nivel energético, en la mayoría de los casos el objetivo es tener ocho electrones en esta última nube para así poder ser estable (que para ellos se traduce en parecerse lo más posible al gas noble más cercano, tratando de copiar su estructura).
Nombre del sitio: CONCEPTODEFINICION.DE Año: 2015
http://conceptodefinicion.de/enlace-quimico/

Los elementos al combinarse unos con otros, aceptan, ceden o comparten electrones con la finalidad de tener 8 electrones en su nivel más externo, esto es lo que se conoce como la regla del octeto.
Enlace Iónico
Está formado por metal + no metal
No forma moléculas verdaderas, existe como un agregado de aniones (iones negativos) y cationes (iones positivos).
Los metales ceden electrones formando por cationes, los no metales aceptan electrones formando aniones. Un ejemplo común de enlace iónico es el NaCl (sal).
Los compuestos formados por enlaces iónicos tienen las siguientes características:
Son sólidos a temperatura ambiente, ninguno es un líquido o un gas.
Son buenos conductores del calor y la electricidad.
Tienen altos puntos de fusión y ebullición.
Son solubles en solventes polares como el agua.
FORMACION DE ENLACES IONICOS
Ejm: NaF
![]()
Na: metal del grupo IA ENLACE
F: no metal del grupo VIIA
IONICO
La estructura de Lewis del compuesto se representa de la siguiente forma:
[Na] 1+
.. 1-
[:F:]
..
Enlace Covalente
Está basado en la compartir electrones. Los átomos no ganan ni pierden electrones, COMPARTEN.
Está formado por elementos no metálicos. Pueden ser 2 o 3 no metales.
Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los elementos que se unen. Este tipo de enlace está en el ADN, en las proteínas, el H2O y el CO2.
Las características de los compuestos unidos por enlaces covalentes son:
Los compuestos covalentes pueden presentarse en cualquier estado de la materia: solido, líquido o gaseoso.
Son malos conductores del calor y la electricidad.
Tienen punto de fusión y ebullición relativamente bajos.
Son solubles en solventes polares como benceno, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
Ejm: O2 .La molécula de oxigeno también es diatómica. Por ser del grupo VIA la estructura de Lewis del oxígeno es:
..
: O .
.
Al oxigeno le hacen falta dos electrones para completar su octeto. Cada oxigeno dispone de 6 electrones, con los cuales ambos deben tener al final ocho electrones. Por lo tanto el total de electrones disponibles es: 2 x 6 e- = 12 e- menos dos que se ocupan para el enlace inicial restan 10.
Estos 10 e- se colocan por pares al azar entre los dos átomos.
..
: O - ..
.. : O
Ahora revisamos cuantos electrones tiene cada átomo alrededor. Observamos que el oxígeno de la izquierda está completo, mientras que el de la derecha tiene solo seis. Entonces uno de los pares que rodean al oxigeno de la izquierda, se coloca entre los dos átomos formándose un doble enlace, y de esa forma los dos quedan con 8 electrones.
.. ..
: O = O:
La molécula queda formada por un enlace covalente doble, 4 electrones enlazados y 4 pares de electrones no enlazados.
Nombre del sitio: ENLACES QUÍMICOS Año: consulta 2017
http://genesis.uag.mx/edmedia/material/qino/T6.cfm
Enlace Metálico
Los átomos de los elementos metálicos se caracterizan por tener pocos electrones de valencia (electrones de la última capa). No pueden formar enlaces covalentes, pues compartiendo electrones no pueden llegar a adquirir la estructura de gas noble.
La estabilidad la consiguen de otro modo, los electrones de valencia de cada átomo entran a formar parte de "un fondo común", constituyendo una nube electrónica que rodea a todo el conjunto de iones positivos dispuestos ordenadamente, formando un cristal metálico. Es el tipo de enlace entre los átomos de elementos metálicos como Ag (plata), Au (oro), Cu (cobre), Ni (níquel), Fe (hierro), Pb (plomo), entre muchos otros.
PROPIEDADES: La estructura comentada puede explicar las propiedades claramente.
Alta conductividad térmica y eléctrica, los electrones pueden moverse con libertad por la nube electrónica.
Son dúctiles (factibles de hilar) y maleables (factibles de hacer láminas), su deformación no implica una rotura de enlaces ni una aproximación de iones de igual carga, como ocurría en los compuestos iónicos por ejemplo.
Los puntos de fusión son moderadamente altos, la estabilidad de la red positiva circundada por la nube de electrones es alta.
Son difícilmente solubles en cualquier disolvente, por el mismo motivo que justifica el punto anterior. (Pensar en la forma de "atacar" el agua a un compuesto iónico, en un metal que es "un todo uniforme" no existe esa posibilidad.
Nombre del sitio: ENLACE QUÍMICO Año: consulta 2017
http://platea.pntic.mec.es/~jrodri5/web_enlaces_quimicos/enlace_metalico.htm
La reacción química
Proceso químico en el cual dos o más sustancias llamadas reaccionantes o reactivos, por efecto de un factor
energético, se transforman en otras sustancias llamadas productos. Esas sustancias pueden ser elementos o
![]()
compuestos…Las ecuaciones químicas son el modo de representar a las reacciones químicas…
Nombre del sitio: EcuRed Año: consulta 2017
https://www.ecured.cu/Reacci%C3%B3n_qu%C3%ADmica
Características de las reacciones químicas
La o las sustancias nuevas que se forman suelen presentar un aspecto totalmente diferente del que tenían las sustancias de partida.
Durante la reacción se desprende o se absorbe energía:
Reacción exotérmica: se desprende energía en el curso de la reacción.
Reacción endotérmica: se absorbe energía durante el curso de la reacción.
Se cumple la ley de conservación de la masa: la suma de las masas de los reactivos es igual a la suma de las masas de los productos. Esto es así porque durante la reacción los átomos ni aparecen ni desaparecen, sólo se reordenan en una disposición distinta.
Nombre del sitio: quimicaweb Año: consulta 2017
http://www.quimicaweb.net/grupo_trabajo_fyq3/tema6/index6.htm
Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión…
Se reconocen dos grandes modelos de reacciones químicas, las reacciones ácido-base, que no presentan modificaciones en los estados de oxidación y las reacciones redox, que por el contrario sí presentan modificaciones en los estados de oxidación.
En tanto, dependiendo del tipo de productos que resulta de la reacción a las reacciones químicas se las clasifica de la siguiente manera: reacción de síntesis (elementos o compuestos simples se unen para conformar un compuesto más complejo), reacción de descomposición (el compuesto se fragmenta en elementos o compuestos más simples; un solo reactivo se convierte en productos), reacción de desplazamiento o simple sustitución (un elemento reemplaza a otro en un compuesto) y reacción de doble desplazamiento o doble sustitución (los iones de un compuesto modifican lugares con los propios de otro compuesto para conformar dos sustancias diferentes).
Nombre del sitio: Definición ABC Año: 2017
https://www.definicionabc.com/ciencia/reaccion-quimica.php
El cambio químico
Cambios Químicos
Estos conllevan una variación en la composición de la naturaleza de la materia, es decir, a partir de una porción de material llamada reactivo, se obtiene un material distinto denominado producto, por medio de una reacción química, en la cual pueden influir diversos factores tales como la luz, presión, temperatura u otras sustancias reactivas
Por ejemplo, al dejar una barra de hierro a la intemperie durante algún tiempo (estado inicial), al término de éste, se observa que un polvo rojizo la cubre, llamado oxido o herrumbre (estado final). Inmediatamente surge la pregunta ¿Qué ha ocurrido? Aparentemente ha habido un cambio; ¿Qué es lo que lo ha producido? Sencillamente el oxígeno del aire húmedo ha oxidado el material, el cual presenta características diferentes a las del estado inicial, pues ha perdido el color y el brillo característicos del metal.
Cambios químicos de la materia
Oxidación de un metal | La quema de juegos artificiales |
Combustión de la gasolina | La reacción del bicarbonato con vinagre |
Digestión de los alimentos | Carne quemada |
La respiración celular | Incendio de un bosque |
La fotosíntesis | Reacción de los ácidos con los carbonatos |
En los cambios químicos se producen nuevas sustancias totalmente distintas a las sustancias iniciales. Veamos por ejemplo en el caso de la combustión completa de un material como la leña, los productos finales son: dióxido de carbono (gas), vapor de agua, energía en forma de luz y calor y cenizas.
Nombre del sitio: EXPERIMENTOSFACILES.COM Año: 2017
http://www.experimentosfaciles.com/20-ejemplos-de-cambios-fisicos-y-quimicos-de-la-materia/
La ecuación química: su interpretación
Interpretación de una ecuación química
Un caso general de ecuación química sería, donde:
![]()
A, B, C, D, representan los símbolos químicos de las moléculas o átomos que reaccionan (lado izquierdo) y los que se producen (lado derecho).
a, b, c, d, representan los coeficientes estequiométricos, que deben ser ajustados de manera que sean reflejo de la ley de conservación de la masa.
La interpretación física de los coeficientes estequiométricos, si estos son números enteros y positivos, puede ser en átomos o moles:
Así, se diría de la ecuación de geometría estequiometrica se subdivide en la siguiente:
Cuando "b" átomos (o moléculas) de A reaccionan con "b" átomos (o moléculas) de B producen "c" átomos (o moléculas) de C, y "d" átomos (o moléculas) de D.
Cuando "a" moles de átomos (o moléculas) de A reaccionan con "b" moles de átomos (o moléculas) de B producen "c" moles de átomos (o moléculas) de C, y "d" moles de átomos (o moléculas) de D.
![]()
Por ejemplo el hidrógeno (H2) puede reaccionar con oxígeno (O2) para dar agua (H2O). La ecuación química para esta reacción se escribe:
![]()
El símbolo "+" se lee como "reacciona con", mientras que el símbolo "→" significa "irreversible" o "produce". Para ajustar la ecuación, ponemos los coeficientes estequiométricos.
La ecuación está ajustada o balanceada y puede ser interpretada como 2 mol de moléculas de hidrógeno reaccionan con 1 mol de moléculas de oxígeno, produciendo 2 mol de moléculas de agua.
Las fórmulas químicas a la izquierda de "→" representan las sustancias de partida, denominadas reactivos o reactantes; a la derecha de "→" están las fórmulas químicas de las sustancias producidas, denominadas productos.
Los números delante de las fórmulas son llamados coeficientes estequiométricos. Estos deben ser tales que la ecuación química esté balanceada, Es decir, que el número de átomos de cada elemento de un lado y del otro sea el mismo. Los coeficientes deben ser enteros positivos, y el uno se omite. En las únicas reacciones que esto no se produce, es en las reacciones nucleares.
Adicionalmente, se pueden agregar (entre paréntesis y como subíndice) el estado de cada sustancia participante: sólido (S), líquido (l), acuoso (Ac) O gaseoso (g). En el ejemplo del agua:
![]()
Nombre del sitio: Cepaalacelula Año: 2011
http://cepaalacelula.webnode.es/news/interpretacion-de-una-ecuacion-quimica/
El mol como unidad de medida
Hay muchas formas distintas de medir la cantidad de materia. Tradicionalmente se utiliza una unidad de masa, el kilogramo, y en función del número de veces que una porción de materia contiene al kilogramo así expresamos su cantidad de materia. Sin embargo, las sustancias son muy distintas unas de otras. Las aparentemente grandes no tienen que ser necesariamente más masivas que las más pequeñas. Depende lógicamente de la densidad de estos cuerpos.
Hoy en día sabemos que cualquier sustancia está formada por sucesivas uniones de otras partículas más pequeñas que son sus unidades constituyentes, por tanto sería lógico medir la cantidad de materia por el número de individualidades que la formen; por ejemplo podríamos ir al mercado y pedir 2 kilogramos de peras (pedimos la masa de peras que queremos), o bien pedimos una docena de peras, en ambos casos nuestra petición es coherente, (en este último caso hemos pedido las peras que queremos como una cantidad de elementos constituyentes).
Basándonos en esta última forma de medir la materia, en Química, se utiliza una unidad a la que se le llama mol. Un mol es la cantidad de materia que contiene el Número de Avogadro de partículas constituyentes. Este número es 6,023x1023. Si ese tipo de materia es un elemento químico, las partículas serán átomos; en caso de que se trate de un compuesto, las partículas serán moléculas. Esta nueva unidad que estamos definiendo hace que para las diferentes sustancias, un mol de una no tenga la misma masa en gramos o kilogramos que para otra sustancia, haciendo un pequeño símil como el anterior -no puede ser igual la masa de 100 "tuercas" que la masa de 100 "destornilladores"-, aunque en ambos casos haya el mismo número de unidades.
El problema para medir moles reside en su propio concepto: no se puede tomar un mol de una sustancia a base de contar partículas (ya sean átomos, moléculas o iones) debido a lo grande que es el Número de Avogadro y al hecho de que es imposible "coger" una de estas unidades. Por eso, en el laboratorio, para realizar cálculos se necesita encontrar una relación entre el mol y otra magnitud más fácil de medir: la masa…
Nombre del sitio: Principia Año: consulta 2017
http://www.principia-malaga.com/p/images/pdf/mol.pdf

Nombre del sitio: SlideShare Año: 2010
https://es.slideshare.net/UDOESTELI/calculo-de-moles
Ácidos y bases importantes en nuestra vida cotidiana
Cuando en una solución la concentración de iones hidrógeno (H+) es mayor que la de iones hidroxilo (OH –), se dice que es ácida. En cambio, se llama básica o alcalina a la solución cuya concentración de iones hidrógeno es menor que la de iones hidroxilo.
Una solución es neutra cuando su concentración de iones hidrógeno es igual a la de iones hidroxilo. El agua pura es neutra porque en ella [H + ] = [OH – ]. (Ver: Ionización del agua )
La primera definición de ácido y base fue acuñada en la década de 1880 por Svante Arrhenius quien los define como sustancias que pueden donar protones (H +) o iones hidróxido (OH - ), respectivamente. Esta definición es por supuesto incompleta, pues existen moléculas como el amoniaco (NH 3 ) que carecen del grupo OH - y poseen características básicas.
Una definición más general fue propuesta en 1923 por Johannes Brönsted y Thomas Lowry quienes enunciaron que una sustancia ácida es aquella que puede donar H + , exactamente igual a la definición de Arrhenius; pero a diferencia de éste, definieron a una base como una sustancia que puede aceptar protones.
Una definición más general sobre ácidos y bases fue propuesta por Gilbert Lewis quien describió que un ácido es una sustancia que puede aceptar un par de electrones y una base es aquella que puede donar ese par.
Los ácidos y las bases se caracterizan por:
Ácidos | Bases |
Tienen sabor agrio (limón, vinagre, etc). | Tiene sabor cáustico o amargo (a lejía) |
En disolución acuosa enrojecen la tintura o papel de tornasol | En disolución acuosa azulean el papel o tintura de tornasol |
Decoloran la fenolftaleína enrojecida por las bases | Enrojecen la disolución alcohólica de la fenolftaleína |
Producen efervescencia con el carbonato de calcio (mármol) | Producen una sensación untuosa al tacto |
Reaccionan con algunos metales (como el cinc, hierro,…), desprendiendo hidrógeno | Precipitan sustancias disueltas por ácidos |
Neutralizan la acción de las bases | Neutralizan la acción de los ácidos |
En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellos, al mismo tiempo una descomposición química | En disolución acuosa dejan pasar la corriente eléctrica, experimentando ellas, al mismo tiempo, una descomposición química |
Concentrados destruyen los tejidos biológicos vivos (son corrosivos para la piel) | Suaves al tacto pero corrosivos con la piel (destruyen los tejidos vivos) |
Enrojecen ciertos colorantes vegetales | Dan color azul a ciertos colorantes vegetales |
Disuelven sustancias | Disuelven grasas y el azufre |
Pierden sus propiedades al reaccionar con bases | Pierden sus propiedades al reaccionar con ácidos |
Se usan en la fabricación de jabones a partir de grasas y aceites |
Tanto ácidos como bases se encuentran en gran cantidad en productos usados en la vida cotidiana, para la industria y la higiene, así como en frutas y otros alimentos, mientras que el exceso o defecto de sus cantidades relativas en nuestro organismo se traduce en problemas de salud.
Escala de pH
Los ácidos y las bases tienen una característica que permite medirlos: es la concentración de los iones de hidrógeno (H+). Los ácidos fuertes tienen altas concentraciones de iones de hidrógeno y los ácidos débiles tienen concentraciones bajas. El pH, entonces, es un valor numérico que expresa la concentración de iones de hidrógeno.
Hay centenares de ácidos. Ácidos fuertes, como el ácido sulfúrico, que puede disolver los clavos de acero, y ácidos débiles, como el ácido bórico, que es bastante seguro de utilizar como lavado de ojos. Hay también muchas soluciones alcalinas, llamadas "bases", que pueden ser soluciones alcalinas suaves, como la Leche de Magnesia, que calman los trastornos del estómago, y las soluciones alcalinas fuertes, como la soda cáustica o hidróxido de sodio, que puede disolver el cabello humano.
Los valores numéricos verdaderos para estas concentraciones de iones de hidrógeno marcan fracciones muy pequeñas, por ejemplo 1/10.000.000 (proporción de uno en diez millones). Debido a que números como este son incómodos para trabajar, se ideó o estableció una escala única. Los valores leídos en esta escala se llaman las medidas del "pH”. Unidades, del 0 (la acidez máxima) a 14 (nivel básico máximo). El número 7 representa el nivel medio de la escala, y corresponde al punto neutro. Los valores menores que 7 indican que la muestra es ácida. Los valores mayores que 7 indican que la muestra es básica.
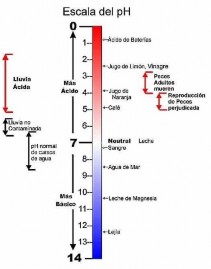
La escala pH tiene una secuencia logarítmica, lo que significa que la diferencia entre una unidad de pH y la siguiente corresponde a un cambio de potencia 10. En otras palabras, una muestra con un valor pH de 5 es diez veces más ácida que una muestra de pH 6. Asimismo, una muestra de pH 4 es cien veces más ácida que la de pH 6.
Cómo se mide el pH
Una manera simple de determinarse si un material es un ácido o una base es utilizar papel de tornasol. El papel de tornasol es una tira de papel tratada que se vuelve color rosa cuando está sumergida en una solución ácida, y azul cuando está sumergida en una solución alcalina.
Los papeles tornasol se venden con una gran variedad de escalas de pH. Para medir el pH, seleccione un papel que dé la indicación en la escala aproximada del pH que vaya a medir. Si no conoce la escala aproximada, tendrá que determinarla por ensayo y error, usando papeles que cubran varias escalas de sensibilidad al pH.
Para medir el pH, sumerja varios segundos en la solución el papel tornasol, que cambiará de color según el pH de la solución. Los papeles tornasol no son adecuados para usarse con todas las soluciones. Las soluciones muy coloreadas o turbias pueden enmascarar el indicador de color.
El método más exacto y comúnmente más usado para medir el pH es usando un medidor de pH (o pH metro) y un par de electrodos. Un medidor de pH es básicamente un voltímetro muy sensible, los electrodos conectados al mismo generarán una corriente eléctrica cuando se sumergen en soluciones. Un medidor de pH tiene electrodos que producen una corriente eléctrica; ésta varía de acuerdo con la concentración de iones hidrógeno en la solución.
Nombre del sitio: PROFESOR en línea Año: 2015
http://profesorenlinea.com.mx/Quimica/Acido_base.htm
Las reacciones redox
También llamados reacciones de reducción y oxidación. Son aquellas que ocurren mediante transferencia de electrones, por lo tanto hay sustancias que pierden electrones (se oxidan) y otras que ganan electrones (se reducen)
La gran mayoría de reacciones que son de interés, en química son reacciones de reducción y oxidación, como ejemplos tenemos: la combustión de los hidrocarburos, la acción de los agentes blanqueadores de uso doméstico, la obtención de los metales a partir de sus minerales, el proceso de respiración, proceso de digestión, reacción que ocurre en la pila seca y baterías, etc..
Oxidación
Es el fenómeno mediante el cual una especie química pierde electrones, por lo tanto el número de oxidación (N.O.) aumenta algebraicamente porque pierde carga negativas.
Ejemplos:
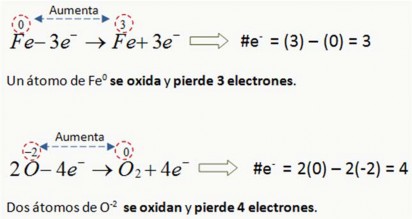
Reducción
Es el fenómeno mediante el cual una especie química gana electrones, por lo tanto el número de oxidación (N.O.) disminuye algebraicamente porque gana carga negativas.
Ejemplos:

El agente oxidante, es la sustancia química que al reducirse provoca la oxidación de otro; por lo tanto la sustancia que se reduce es agente oxidante.
El agente reductor, es la sustancia quimia que al oxidarse provoca o causa la reducción de otro; por lo tanto la sustancia que se oxida es agente reductor.
A continuación se ilustra en forma resumida una reacción redox:
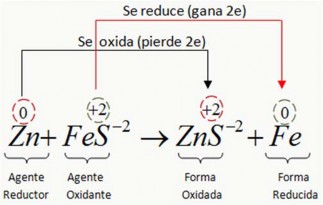
Descripción del Proceso:
El átomo neutro del Zn (Zn0) pierde 2 electrones y se convierte en ion cinc (Zn+2) según la siguiente reacción: Zn0 → Zn+2 + 2e semireacción de oxidación
Los dos átomos que pierde el Zn es ganado por el ión ferroso (Fe+2) para convertirse en átomo neutro (Fe0) Fe+2 + 2e- → Fe0 semireacción de reducción
El ión Zn+2 es forma oxidada del Zn0 y el Fe0 es la forma reducida del Fe+2
El sulfuro ferroso FeS, se llama oxidante porque contiene al ión Fe+2, que al reducirse provoca la oxidación del Zn. Al sulfuro de Zinc, ZnS, se le llama forma oxidada porque contiene al Zn+2 que es la forma oxidada del Zn0
Como se puede apreciar en la ilustración anterior, para reconocer que una sustancia se oxida o se reduce, solo basta analizar como varia el número de oxidación de una especie química al pasar de reactantes a productos. En toda reacción redox se cumple:
El fenómeno de reducción y oxidación es simultáneo, es decir la oxidación y reducción no se presenta en forma aislada
#e- (ganados) = #e- (perdidos)
La igualdad justifica la ley de conservación de carga eléctrica.
Nombre del sitio: Química. Química Inorgánica Año: 2012
http://www.fullquimica.com/2011/12/reacciones-redox.html
VIDEO DE INTRODUCCIÓN A LAS REACCIONES REDOX Nombre del sitio: KHANACADEMY
Año: 2017
https://es.khanacademy.org/science/chemistry/oxidation-reduction/redox-oxidation-reduction/v/oxidation- reduction-or-redox-reactions